テクノロジーに加えて、配糖体の合成は自然界で非常に一般的な反応であるため、常に科学の関心を集めてきました。Schmidt、Toshima、Tutatsu による最近の論文、およびそこに引用されている多くの参考文献は、幅広い合成の可能性についてコメントしています。
グリコシドの合成では、多糖成分がアルコール、炭水化物、タンパク質などの求核剤と結合します。炭水化物のヒドロキシル基の 1 つとの選択的反応が必要な場合、他のすべての機能は保護されなければなりません。最初の一歩。原則として、酵素または微生物のプロセスは、その選択性により、領域内の配糖体から選択的に行う複雑な化学的保護および脱保護ステップを置き換えることができます。しかし、アルキルグリコシドの長い歴史のため、グリコシドの合成における酵素の応用は広く研究され、応用されていませんでした。
適切な酵素系の能力と高い製造コストのため、アルキルポリグリコシドの酵素合成は工業レベルにアップグレードする準備ができておらず、化学的方法が好まれています。
1870年にMAcolleyは、ブドウ糖(グルコース)と塩化アセチルの反応による「アセトクロルヒドロス」の合成を報告し(1、図2)、これが最終的にグリコシド合成経路の歴史につながりました。
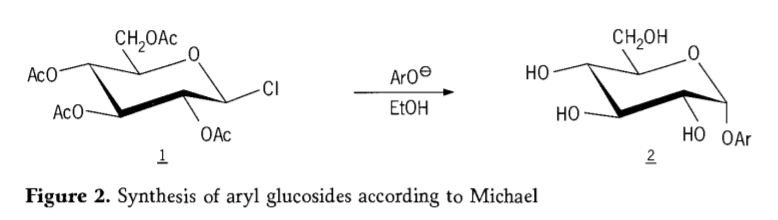
テトラ-O-アセチル-グルコピラノシルハライド(アセトハログルコース)は、純粋なアルキルグルコシドの立体選択的合成に有用な中間体であることが後に判明しました。1879 年、アーサー マイケルは、コリーの中間体とフェノラートから明確な結晶化可能なアリール グリコシドを調製することに成功しました。(Aro-、図 2)。
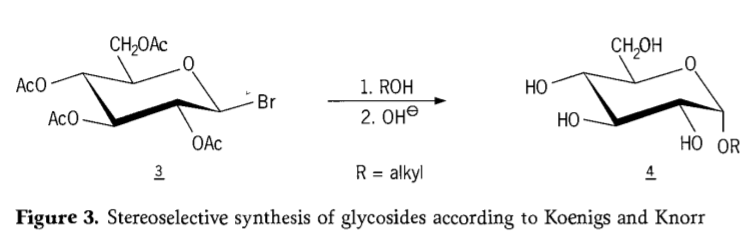
1901 年、W.Koenigs と E.Knorr が改良された立体選択的グリコシド化プロセスを導入したとき、Michael は広範囲の炭水化物とヒドロキシルアグリコンを合成しました (図 3)。この反応にはアノマー炭素での SN2 置換が含まれ、立体配置の反転によって立体選択的に進行し、たとえばアセオブロモグルコース中間体 3 の β アノマーから α-グルコシド 4 が生成されます。ケーニヒス・クノール合成は銀または銀の存在下で行われます。水銀促進剤。
1893 年、エミール フィッシャーは、アルキル グルコシドの合成に対する根本的に異なるアプローチを提案しました。このプロセスは現在「フィッシャーグリコシド化」としてよく知られており、グリコースとアルコールの酸触媒反応を含みます。それにも関わらず、あらゆる歴史的記述には、塩酸の存在下でブドウ糖を無水エタノールで変換するという、1874 年に報告された A.Gautier の最初の試みも含まれているはずです。誤解を招く元素分析により、ゴーティエは自分が「ジグルコース」を取得したと信じていました。フィッシャーは後に、ゴーティエの「ジグルコース」が実際には主にエチルグルコシドであることを証明しました (図 4)。
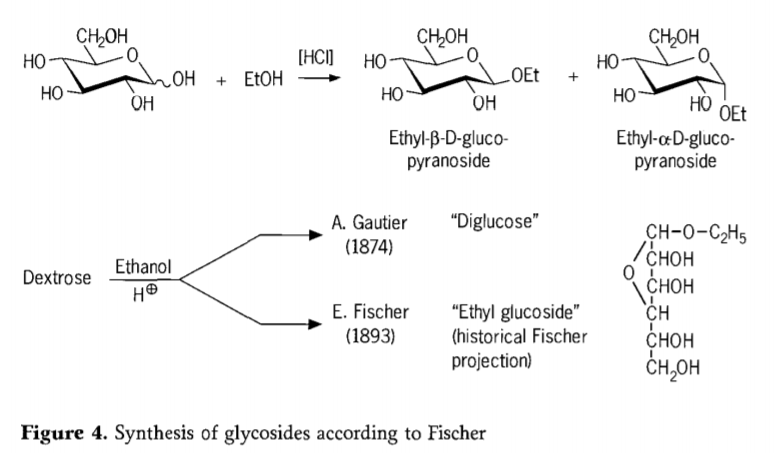
提案された歴史的なフラノシドの式からわかるように、フィッシャーはエチル グルコシドの構造を正確に定義しました。実際、フィッシャーのグリコシド化生成物は複雑で、ほとんどがα/β-アノマーとピラノシド/フラノシド異性体の平衡混合物であり、これらにはランダムに結合したグリコシド オリゴマーも含まれます。
したがって、フィッシャー反応混合物から個々の分子種を単離するのは容易ではなく、これは過去に深刻な問題であった。この合成法をいくらか改良した後、フィッシャーは研究にケーニヒス・クノール合成を採用しました。このプロセスを使用して、E.Fischer と B.Helferrich は 1911 年に界面活性剤特性を示す長鎖アルキル グルコシドの合成を初めて報告しました。
フィッシャーは 1893 年の時点で、特に強アルカリ性媒体中での酸化や加水分解に対する高い安定性など、アルキルグリコシドの重要な特性に正しく気づいていました。どちらの特性も、界面活性剤用途におけるアルキルポリグリコシドにとって貴重です。
グリコシド化反応に関する研究は現在も進行中であり、最近ではグリコシドへの興味深い経路がいくつか開発されています。配糖体の合成手順の一部を図 5 にまとめます。
一般に、化学的グリコシド化プロセスは、酸触媒によるグリコシル交換における複雑なオリゴマー平衡をもたらすプロセスに分割できます。
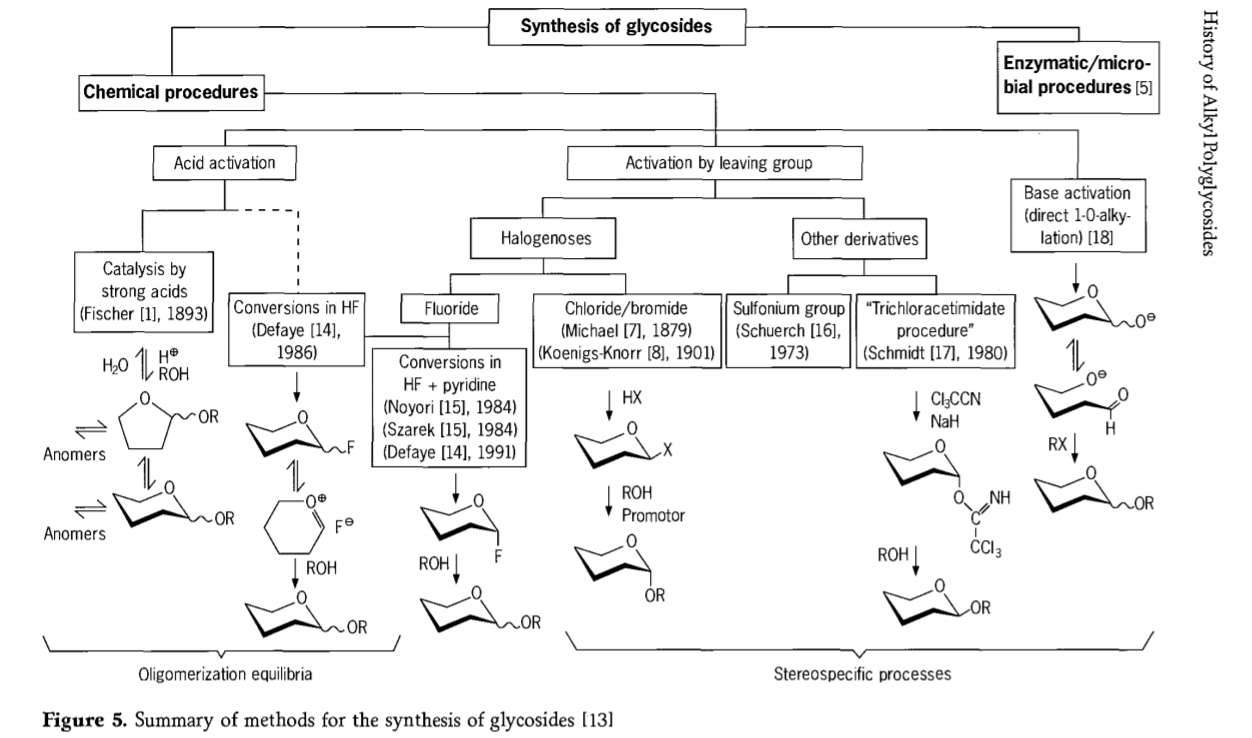
適切に活性化された炭水化物基質に対する反応(保護されていない炭水化物分子とのフィッシャーグリコシド反応およびフッ化水素(HF)反応)および反応速度論が制御された不可逆的で主に定位置換反応。2 番目のタイプの手順は、特に保護団体の技術と組み合わせた場合、反応の複雑な混合物ではなく、個々の種の形成につながる可能性があります。炭水化物は、異所性炭素上にハロゲン原子、スルホニル、トリクロロアセトイミデート基などの基を残すか、トリフレートエステルに変換される前に塩基によって活性化されることがあります。
フッ化水素またはフッ化水素とピリジンの混合物 (ピリジニウム ポリ [フッ化水素]) 中でのグリコシド化の特定の場合、フッ化グリコシルがその場で形成され、たとえばアルコールによりスムーズにグリコシドに変換されます。フッ化水素は、強力に活性化する非分解性の反応媒体であることが示されています。反応機構はおそらく異なるものの、平衡自己縮合(オリゴマー化)はフィッシャープロセスと同様に観察されます。
化学的に純粋なアルキルグリコシドは、非常に特殊な用途にのみ適しています。たとえば、アルキルグリコシドは、オクチル β-D-グルコピラノシドの存在下でのポリンやバクテリオロドプシンの三次元結晶化など、膜タンパク質の結晶化のための生化学研究で成功裏に使用されています(この研究に基づくさらなる実験はノーベル賞受賞につながります) 1988年にダイゼンホーファー、フーバー、ミシェルが化学賞を受賞)。
アルキルポリグリコシドの開発の過程で、立体選択的方法は、その複雑さ、中間体の不安定性、プロセスの量と重要な性質のため、さまざまなモデル物質を合成し、その物理化学的特性を研究するために実験室規模で使用されてきました。ワースター、ケーニヒス・クノール型の合成、およびその他の保護基技術は、重大な技術的および経済的問題を引き起こす可能性があります。フィッシャータイプのプロセスは比較的複雑さが少なく、商業規模での実施が容易であるため、大規模なアルキルポリグリコシドの製造に好ましい方法です。
投稿時間: 2020 年 9 月 12 日





